PCR ist schon eine ganze Zeit in aller Munde, da sie bei COVID-19-Tests als wichtige Analysemethode eine große Rolle spielt. Dieser Begriff, der meist Wissenschaftlern (vor allem Biologen) vorbehalten ist, gehört mittlerweile zu unserem Standardvokabular, als ob wir alle genau wüssten, wovon wir sprechen. Aber was eigentlich ist PCR? PCR steht für Polymerase-Ketten-Reaktion, eine Labormethode, mit der Kopien eines DNA-Segments schnell erstellt werden können. Wissenschaftler können ein sehr kleines Fragment von DNA-Sequenzen entnehmen und es zu einer ausreichend großen Menge amplifizieren, um es in einem zweiten Schritt detailliert zu untersuchen.
Für den COVID-19-Test wird die RT-PCR (Reverse Transkriptase-Polymerase-Kettenreaktion) verwendet: Substanzen, die als Reverse Transkriptase oder DNA-Polymerase bekannt sind, werden im einem Labor einer nasopharyngealen Probe hinzugefügt. Coronaviren enthalten ein nicht segmentiertes RNA-Genom. Reverse Transkriptase wird benötigt, um virale RNA in cDNA (komplementäre DNA) zu transkribieren. Die cDNA kann anschließend als Ausgangsmaterial in einer PCR verwendet werden, um daraus mittels DNA-Polymerase spezifische Sequenzen zu amplifizieren. Speziell entwickelte Primer und Sonden lagern sich an Sequenzen der cDNA an und signalisieren so, dass ein Erreger gefunden wurde.
Diese Methode wird zur schnellen medizinischen Diagnostik von Krankheiten wie COVID-19, aber auch Tuberkulose und anderen Infektionen eingesetzt und hat sich ebenfalls in der biomedizinischen Forschung und der Kriminaltechnik durchgesetzt. Es gibt jedoch nicht nur eine einzige PCR-Methode. Im Folgenden finden Sie eine Tabelle, in der die wichtigsten Vor- und Nachteile der einzelnen Methoden erläutert werden.
Vergleich von Real-Time PCR, herkömmlicher PCR und digitaler PCR auf einen Blick
| Digitale PCR | Real-Time PCR | Herkömmliche PCR | |
|---|---|---|---|
| Überblick | Misst den Anteil der negativen Replikate, um die absoluten Kopien zu bestimmen | Misst die PCR-Amplifikation, während sie abläuft | Misst die Menge des angereicherten PCR-Produkts am Ende der PCR-Zyklen |
| Quantitativ? | Ja, der Anteil negativer PCR-Reaktionen ist an einen statistischen Poisson-Algorithmus angepasst | Ja, da die Daten während der exponentiellen Wachstumsphase (logarithmische) der PCR erfasst werden, in der die Menge des PCR-Produkts direkt proportional zur Menge des Nukleinsäure-Templates ist. | Nein, obwohl der Vergleich der Intensität der amplifizierten Bande auf einem Gel mit Standards einer bekannten Konzentration „semiquantitative“ Ergebnisse liefern kann. |
| Anwendungen |
|
| Amplifikation von DNA für:
|
| Zusammenfassung | Vorteile der digitalen PCR:
| Vorteile der Real-Time PCR:
| Nachteile herkömmlicher PCR:
|
Um zu verstehen, warum die herkömmliche PCR limitiert ist, ist es wichtig, zu verstehen, was während einer PCR-Reaktion geschieht. Ein grundlegender PCR-Lauf kann in drei Phasen unterteilt werden:
- Exponentiell
Mit jedem Zyklus verdoppelt sich die Anreicherungsmenge des Produkts (eine 100%ige Reaktionseffizienz vorausgesetzt). Die Reaktion ist sehr spezifisch und präzise. Die exponentielle Amplifikation erfolgt, weil alle Reagenzien frisch und verfügbar sind, die Kinetik der Reaktion treibt die Reaktion hin zur Verdoppelung des Amplikons.
- Linear (hohe Variabilität)
Während die Reaktion fortschreitet, werden einige der Reagenzien infolge der Amplifikation verbraucht. Die Reaktionen werden langsamer und das PCR-Produkt wird nicht mehr bei jedem Zyklus verdoppelt.
- Plateau (Endpunkt: Geldetektion bei herkömmlichen Methoden)
Die Reaktion ist beendet, es werden keine weiteren Produkte hergestellt und wenn sie lange genug stehen gelassen werden, beginnen die PCR-Produkte zu zerfallen. Jedes Röhrchen oder jede Reaktion erreicht das Plateau aufgrund der unterschiedlichen Reaktionskinetik in jeder Probe zu einem anderen Zeitpunkt. Diese Unterschiede können in der Plateauphase beobachtet werden. In der Plateauphase nimmt die herkömmliche PCR ihre Messung vor. Dies wird auch als Endpunktnachweis bezeichnet.
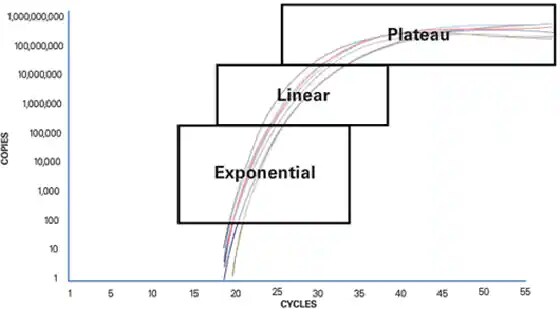
Abbildung 1: PCR-Phasen.
Herkömmliche PCR misst auf dem Plateau und liefert Ihnen variable Ergebnisse
Abbildung 2 zeigt, dass drei Replikate, die zu Beginn der Reaktion die gleiche DNA-Menge enthielten, bei Erreichen der Plateauphase unterschiedliche Mengen an PCR-Produkten aufweisen (aufgrund von Variationen bei der Reaktionskinetik). Daher ist es präziser, Messungen während der exponentiellen Phase durchzuführen, in der die Replikate exponentiell amplifiziert werden.
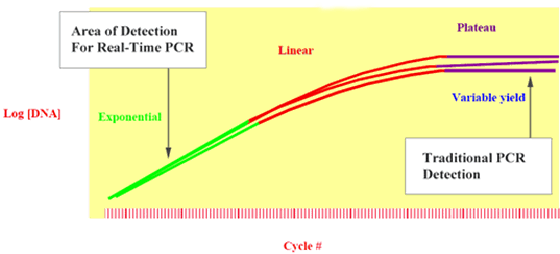
Abbildung 2: Identische Proben erzeugen unterschiedliche Mengen an Reaktionsprodukt, wenn die Plateauphase der PCR erreicht ist.
Real-Time PCR misst während der Exponentialphase und liefert eine genauere Quantifizierung
Die Real-Time PCR konzentriert sich auf die Exponentialphase, da diese die präzisesten und genauesten Daten zur Quantifizierung liefert. In der Exponentialphase berechnet das Real-Time-PCR-Gerät zwei Werte. Die Schwellenwertlinie ist das Nachweisniveau, bei dem eine Reaktion eine Fluoreszenzintensität über dem Hintergrund erreicht. Der PCR-Zyklus, bei dem die Probe diesen Wert erreicht, wird als Schwellenwertzyklus (Cycle Threshold, Ct-Wert) bezeichnet. Der Ct-Wert wird in der nachfolgenden Quantifizierung oder beim Anwesenheits-/Abwesenheitsnachweis verwendet. Durch den Vergleich der Ct-Werte von Proben unbekannter Konzentration mit einer Reihe von Standards kann die Menge der Template-DNA in einer unbekannten Reaktion genau bestimmt werden.
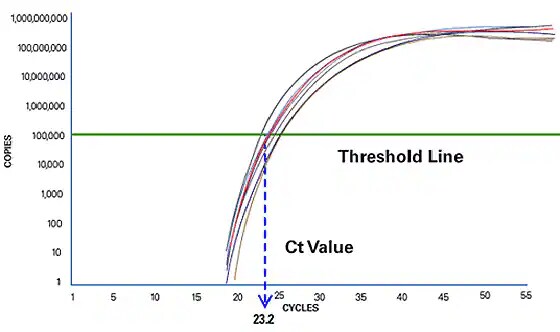
Abbildung 3: Der PCR-Zyklus, bei dem die Probe eine Fluoreszenzintensität über dem Hintergrund erreicht, ist der Schwellenwertzyklus oder Ct-Wert.
Digitale PCR zählt einzelne Moleküle für eine absolute Quantifizierung
Die digitale PCR unterteilt eine Probe in viele einzelne Real-Time-PCR-Reaktionen, von denen einige das Zielmolekül enthalten (positiv) und andere nicht (negativ). Im Anschluss an die PCR-Analyse wird anhand der Fraktion negativer Antworten eine absolute Antwort für die genaue Anzahl der Zielmoleküle in der Probe ermittelt, ohne dass dafür Standards oder endogene Kontrollen erforderlich sind.
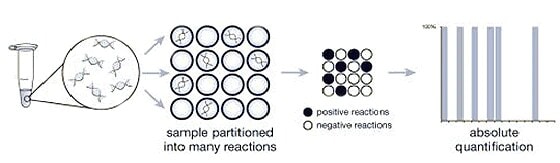
Abbildung 4: Die digitale PCR verwendet das Verhältnis von positiven (schwarz) zu negativen (weiß) PCR-Reaktionen, um die Anzahl der Zielmoleküle zu zählen.
